来源:DeepTech深科技
近日,昆明理工大学季维智院士/李天晴教授/艾宗勇副教授团队,首次绘制了人围着床胚胎的完整细胞图谱。
相关数据填补了人围着床胚胎发育的认知空白,为体外建立的胚胎模型、以及胚胎和胚外细胞谱系的鉴定提供了参考,也为深入理解人围着床胚胎的发育机制、以及揭示不育和胎儿出生缺陷的致病机理奠定重要基础。

研究中,他们在此前建立人胚胎三维延长培养的基础之上,收集了体外延长培养的受精后 10-14 天的人胚胎,并对其进行单细胞转录组测序。
针对上胚层和下胚层衍化而来的不同细胞谱系的身份、标志基因和信号调控网络,课题组进行了深入表征。
进一步地,他们通过免疫荧光染色,又验证了胚外内/中胚层的特异性标志物。
 (来源:Cell Research)
(来源:Cell Research)本次成果的应用前景主要有两方面:
其一,可以促进对于围着床期胚胎发育的理解,能为胚胎异常发育的预防和治疗提供理论支持。
研究中,该团队发现 BMP、WNT 和 Nodal 信号通路,在胚外中胚层、胚外内胚层、羊膜和原条等细胞谱系特化中,扮演着不同的角色。这能为围着床胚胎中特定细胞谱系的异常发育的预防和治疗提供理论支持。
其二,可以为药物筛选和毒理测试提供平台。此次建立的胚胎模型来源于干细胞,易于进行基因编辑和规模化培养,发育效率高达 80% 之上,能够很好地模拟人围着床期胚胎发育,因此可以用其建立与妊娠相关的药物筛选或毒理测试平台。
 (来源:Cell Research)
(来源:Cell Research)据介绍,围着床阶段——指的是受精后的 6 至 14 天。在临床上,60% 左右的胚胎会在围着床阶段出现着床失败或妊娠丢失。
此外,中国胎儿出生缺陷率为 5.6%。着床失败、妊娠丢失和胎儿出生缺陷,与围着床胚胎的异常发育密切相关,但是对其机制人们尚不清楚。
深入解析人围着床胚胎的发育机制,有助于理解胚胎发育与疾病发生的关系,从而为不育和胎儿出生缺陷的诊疗提供理论依据。
近年来,学界成功将病人捐赠的体外受精囊胚培养至原肠前阶段,这为理解围着床阶段的胚胎发育事件提供了机会。
然而,围着床胚胎的完整细胞图谱尚未绘制,特别是上胚层和下胚层衍化而来的细胞谱系的身份特征和信号调控机制依然不甚清楚。
此外,使用人胚胎开展研究受到伦理、数量和技术限制。干细胞来源的胚胎模型,容易开展基因编辑和进行大规模制备,是体外研究人胚胎发育原理和异常发育机制的理想模型,适合用其进行药物研发和毒理测试。
然而,当前已构建的胚胎模型,并不能很好地模拟人围着床胚胎的一些关键组织结构和细胞谱系的发育。
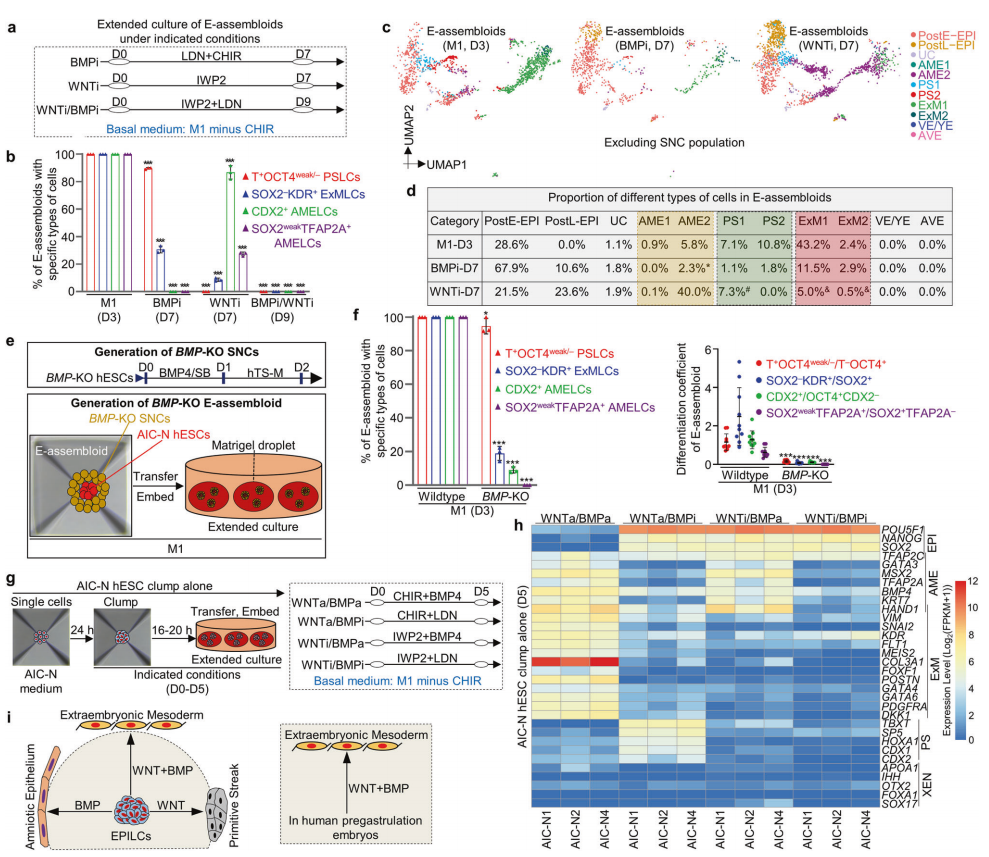
为了建立能够模拟人围着床发育的胚胎模型,季维智课题组首次开发了一种能在常氧条件下维持的人原始态胚胎干细胞。
究中,他们将滋养层干细胞(hTSCs)或滋养外胚层样细胞(nTEs),与原始态胚胎干细胞进行组装。
意外的是,hTSCs 或 nTEs 都不能有效包裹原始态胚胎干细胞,而是形成 8 字型结构,这并不能模拟真实胚胎的形态和结构特征。
为此,他们进一步开发一种信号巢细胞,这种细胞类似人的胚外组织,可以表达 BMP 和 WNT 信号配体。
有趣的是,通过将信号巢细胞和原始态胚胎干细胞进行组装,信号巢细胞能以超过 90% 的效率,包裹人原始态胚胎干细胞,从而组装形成人工合成胚胎。
在延长培养的过程中,人工合成胚胎能够通过发育产生上胚层、胚外中胚层、羊膜和原条等胚胎和胚外组织,但是不能形成胚外内胚层。
为此,他们利用三维培养的人胚胎和人工合成胚胎,采用化学调控和基因编辑等操作,系统揭示了 BMP、WNT 和 Nodal 信号通路,在精确调控人胚胎和胚外细胞谱系上的命运决定机制。
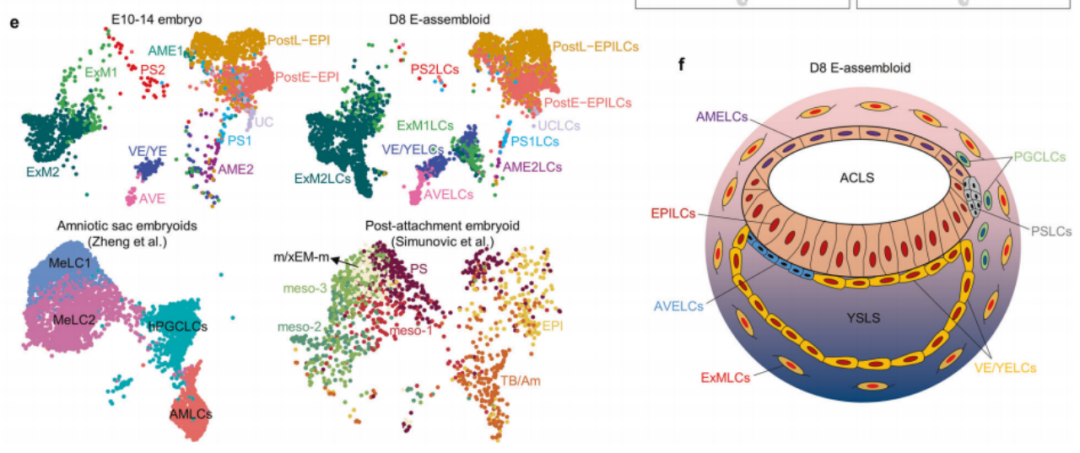
最后,他们基于不同信号通路对于特定细胞谱系特化的调控原理,开发出一个新的“三步”延长培养系统,克服了先前人工合成胚胎不能特化产生胚外内胚层的缺陷,这让 80% 以上的人工合成胚胎生长,其对应人 14 天胚胎的发育阶段,借此成功再现了双胚盘、羊膜腔和卵黄囊的三维结构,以及上胚层、胚外内/中胚层、羊膜、原条和原始生殖细胞等胚胎和胚外细胞谱系的分子特征。
综上,该团队首次绘制了体外培养的人围着床胚胎的完整细胞图谱,并定义了下胚层和上胚层来源的不同细胞谱系,以及这些谱系间的互作关系。
在此基础之上,他们首次构建了能高度模拟人围着床发育的胚胎模型,并系统揭示了 BMP、WNT 和 Nodal 信号通路在精确调控人胚胎和胚外谱系上的命运决定机制。
对于本次研究来说,2019 年 12 月 12 日是一个重要日子。那天,该团队建立了人胚胎的三维延长培养体系,首次将人囊胚在体外培养到原条阶段[2],为绘制人围着床胚胎的单细胞转录图谱奠定基础。
早在 2017 年 3 月,英国剑桥大学团队首次用小鼠的胚胎干细胞(ESCs)和滋养层干细胞(TSCs)进行组装,建立了第一个同时包含胚外组织和胚胎组织的胚胎模型——ETS 胚胎。
在培养过程中,ETS 胚胎很好地再现了小鼠胚胎着床后早期的发育过程[3]。这个突破性的研究,给该团队带来很大的触动。
因为,用人胚胎进行研究面临着伦理关切、胚胎数量少和技术限制等局限,而胚胎模型可以很好地避开“胚胎研究”面临的局限。
然而,不同于小鼠胚胎的研究,人 TSCs 直到 2017 年 12 月,才由日本科学家率先通过囊胚或早期胎盘组织建立[4]。
在此基础之上,后续多个实验室相继诱导人的 ESCs 分化产生 TSCs,这为人胚胎模型的制备带来了曙光。
2018 年初,季维智团队设立“用人的干细胞制备人工合成胚胎”的课题。在“人工合成胚胎”课题的开展过程中,他们也曾遇到一些问题。
首先,如何制定以类似方式制备小鼠 ETS 胚胎的策略。一开始,他们使用人的 TSCs 和原始态 ESCs 进行组装,期间尝试了不同的细胞比例、培养条件和聚集方法后,结果发现 TSCs 不能有效包裹原始态 ESCs。
后来他们发现,当时所建立的 TSCs 对应着床后胚胎的滋养层细胞。因此,他们猜测可能是因为发育阶段不匹配,导致 TSCs 不能有效地包裹原始态 ESCs。
2020 年 2 月,剑桥大学团队首次在生物预印本网站 bioRxiv 刊文,称他们使用原始态 ESCs 分化产生 TSCs 的过程中,细胞会经历一种类似着床前滋养外胚层的中间态。
然而,遗憾的是在复制上述组装过程时,季维智团队发现这种中间态细胞也不能有效地包裹原始态 ESCs。
在这期间,他们耗时半年多建立了一种新方法,即通过诱导始发态 ESCs,让其在经历羊膜中间态之后产生 TSCs。
这时,他们发现在诱导的早期阶段,特别是第二天这些诱导的细胞,能以 90% 以上的效率包裹原始态 ESCs,从而形成胚胎样结构(下称“人工合成胚胎”),这再现了胚胎中滋养外胚层包裹上胚层的结构特征。
但在当时,人工合成胚胎存在两个重要缺陷:
一是细胞谱系发育过快,在 3 天的时间里 70% 左右的细胞快速分化为胚外中胚层、羊膜和原条细胞。而在胚胎中,这大概需要一周的时间;
二是不能产生胚外内胚层和卵黄囊结构,在胚胎发育过程中,胚外内胚层和卵黄囊扮演至关重要的信号调控和营养供给角色。
后来,在深入研究不同信号通路的功能和不同细胞谱系的特化原理后,该团队通过优化培养体系,最终解决了人工合成胚胎的两个缺陷。
 图 | 艾宗勇(来源:艾宗勇)
图 | 艾宗勇(来源:艾宗勇)接下来,他们将使用人工合成胚胎,研究胚外中胚层的发育起源、原肠运动、造血系统发育和早期器官发生。
也将完善人工合成胚胎的制备方法,使其能够比较完整地模拟人围着床胚胎的三维组织结构和不同细胞谱系的发育动态,并用其评估不同环境因素和临床常用药物对于围着床胚胎生长和发育的影响。
 参考资料:
参考资料:1.Xiang et al, Nature, 2020
2.Harrisonet al,Science;2017
3.Okaeet al,Cell Stem Cell;2017
4.Ai, Z., Niu, B., Yin, Y., Xiang, L., Shi, G., Duan, K., ... & Li, T. (2023). Dissecting peri-implantation development using cultured human embryos and embryo-like assembloids. Cell Research, 2023-06.
运营/排版:何晨龙
 季维智院士干细胞
季维智院士干细胞 

 新浪科技公众号
新浪科技公众号 “掌”握科技鲜闻 (微信搜索techsina或扫描左侧二维码关注)
 相关新闻
相关新闻